高血压是严重威胁人类健康的疾病,其患病人数多,病情难以控制,引起医学界广泛关注。积极有效的控制血压对改善生活质量、延长患病人群平均寿命至关重要。尽管积极的降压获益显而易见,但合理的目标值一直是医学界争论的焦点。JNC7 和2007 年欧洲高血压指南均建议对无合并症的高血压患者将血压降至140/90 mm Hg 以下,对合并糖尿病、心血管疾病或慢性肾脏疾病者血压降至130/80 mm Hg 以下。2013 年欧洲高血压指南对降压目标值进行了更新,无论是高危还是低危高血压患者,收缩压目标值均<140 mm Hg;除糖尿病患者舒张压目标值调至85 mm Hg 外,其他患者均<90 mm Hg。本期特邀美国西奈山伊坎医学院Clive Rosendorff 教授及美国韦斯切斯特医学中心/纽约医学院Wilbert S Aronow 教授就高血压目标值问题进行阐述。
有替代终点指标的临床试验
CAMELOT研究中,有274例患者在研究开始及依那普利或氨氯地平降压治疗2年后,采用血管内超声评估冠状动脉(冠脉)粥样斑块体积。结果发现,干预治疗2年后,平均血压仍处于高血压(>140/90 mm Hg)范围者的粥样斑块体积增加,而处于高血压前期(120~129 / 80~89 mm Hg)者的粥样斑块体积无变化,血压降至120/80 mm Hg以下者的粥样斑块体积则显著减小(图3)。
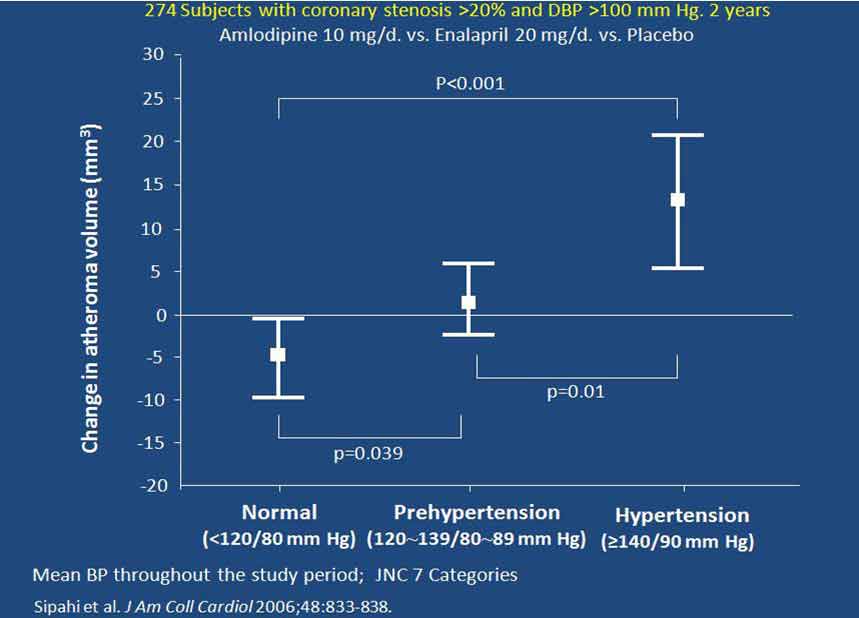
图3. CAMELOT- IVUS亚组研究显示治疗后不同高血压状态的粥样斑块体积改变
由此提出以下问题:为何不将血压降至120/80 mm Hg以下?若这样做有何潜在危害?解决这一问题的关键在于理解重要器官尤其心脏中血流的自我调节。器官的血流量与灌注压成正比,与血流阻力成反比(FαP/R,如图4所示)。对心肌而言,灌注压就是舒张压,因为几乎所有心肌灌注均发生于舒张期。血压过低时,灌注压会降低,将启动自我调节机制扩张阻力血管,从而降低血流阻力,以使血流量保持不变。当然,血管舒张存在极限,超过这一极限后,若灌注压继续降低将导致血流量下降。因此,可预测当舒张压降低幅度超过冠动自我调节极限时,将会发生心肌缺血甚至心肌梗死(MI)。目前的问题是,我们并不知道对伴有冠脉疾病(可降低心肌氧供)或高血压左心室肥厚(可增加心肌耗氧)的患者而言,其舒张压最低界值是多少。因此,亟需前瞻性临床试验验证是否能设置较低的降压目标值。
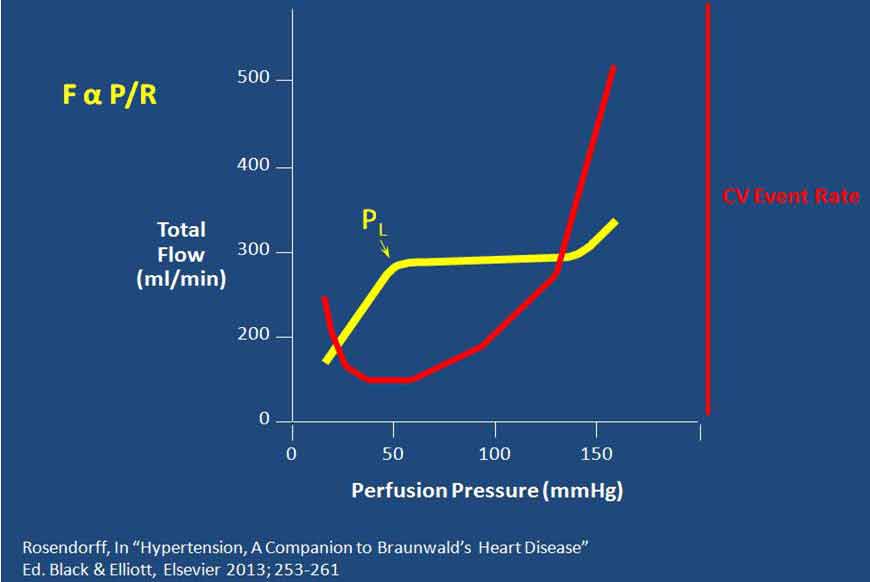
图4. 器官的血流量与灌注压成正比,与血流阻力成反比(PL为血压调节的下限)
有硬终点指标的临床试验
2010年公布的ACCORD(控制糖尿病患者心血管风险行动)研究的血压亚组研究中,受试者被随机分为强化治疗组(降压目标值<120 mm Hg)与常规治疗组(降压目标值为120~139 mm Hg)。研究的主要终点为心血管死亡、MI及卒中的复合终点。中位随访4.7年后,发现标准治疗与强化治疗组的平均收缩压分别为133.5 mm Hg和119.3 mm Hg,差异达14.2 mm Hg。但两组间的主要终点或心血管死亡和MI发生率并无显著差异(图5)。与标准治疗组相比,强化治疗组患者仅有较小的有统计学差异的卒中获益。因此,ACCORD研究者总结,研究结果未能为“强化血压控制降低主要心血管事件复合终点提供证据支持”。
但对上述结果也有不同的解读。其中,大家比较感兴趣的是随访最后4年强化治疗组的平均舒张压为60~65 mm Hg。从冠脉自我调节下限的角度来说,我们需确定的不是“强化治疗是否有益”,而是“强化治疗是否有害”,即在上述较低舒张压水平时,患者的心血管事件发生风险是否会增加。从ACCORD研究结果来看,答案很明确为否定性的。实际上,与常规治疗组相比,强化治疗组主要终点、非致死性MI、严重冠脉疾病发生率均较低,但未达显著统计学差异。此外,强化治疗组的卒中风险有所降低,且有显著统计学意义(图5)。
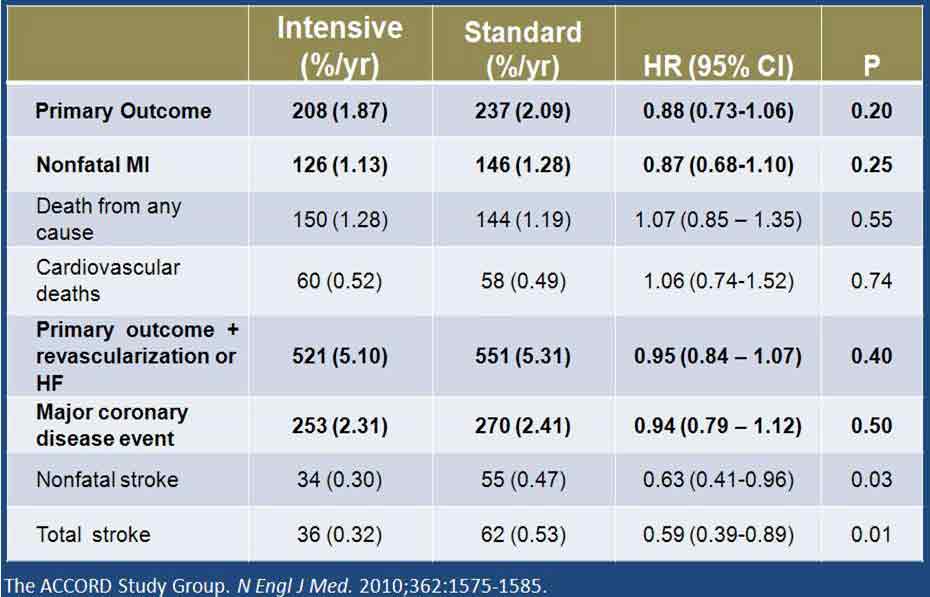
图5. ACCORD研究的主要和次要结果



 京公网安备 11010502033353号
京公网安备 11010502033353号